Zer da titanio dioxidoa?
Titanio dioxidoaren osagai nagusia TIO2 da, pigmentu kimiko ez-organiko garrantzitsua, solido zuri edo hauts moduan agertzen dena. Ez da toxikoa, zuritasun eta distira handia du, eta materialen zuritasuna hobetzeko pigmentu zuririk onena dela uste da. Oso erabilia da estaldura, plastiko, kautxu, paper, tinta, zeramika, beira, etab. bezalako industrietan.

Ⅰ.Titanio dioxidoaren industria-katearen diagrama:
(1)Titanio dioxidoaren industria-katearen goi-mailako aldean lehengaiak daude, besteak beste, ilmenita, titanio kontzentratua, rutiloa, etab.;
(2)Erdiko korronteak titanio dioxidozko produktuei egiten die erreferentzia.
(3) Beheko aldean titanio dioxidoaren aplikazio eremua dago.Titanio dioxidoa hainbat arlotan erabiltzen da, hala nola estalduretan, plastikoetan, papergintzan, tintan, kautxuan, etab.

Ⅱ. Titanio dioxidoaren kristal-egitura:
Titanio dioxidoa konposatu polimorfo mota bat da, naturan hiru kristal forma ohikoenak dituena: anatasa, rutiloa eta brookita.
Bai rutiloa bai anatasa kristal-sistema tetragonalari dagozkio, eta tenperatura normalean egonkorrak dira; brookita kristal-sistema ortorronbikoari dagokio, eta kristal-egitura ezegonkorra du, beraz, gaur egun balio praktiko gutxi du industrian.

Hiru egituren artean, rutilo fasea da egonkorrena. Anatasa fasea, berriz, 900 °C-tik gora rutilo fasean eraldatuko da itzulezin, eta brookita fasea, berriz, 650 °C-tik gora rutilo fasean.
(1) Rutilo faseko titanio dioxidoa
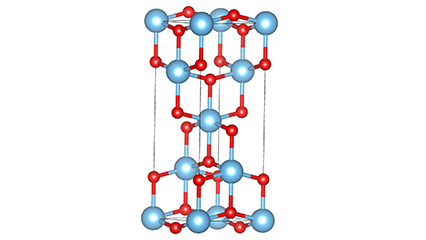
Rutilo faseko titanio dioxidoan, Ti atomoak kristal-sarearen erdian daude, eta sei oxigeno atomo titanio-oxigeno oktaedroaren izkinetan. Oktaedro bakoitza inguruko 10 oktaedrorekin konektatuta dago (zortzi erpin partekatu eta bi ertz partekatu barne), eta bi TiO2 molekulek unitate-zelula osatzen dute.
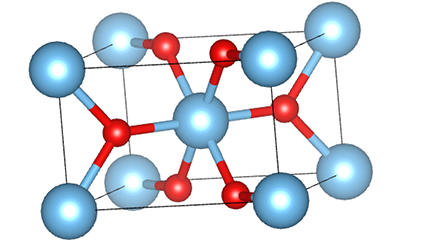
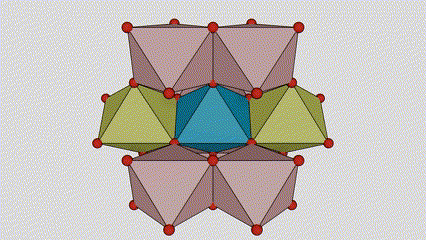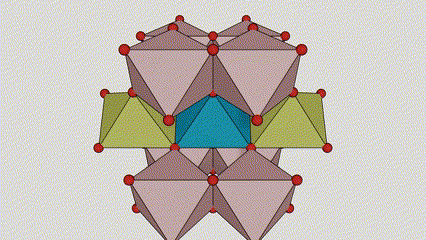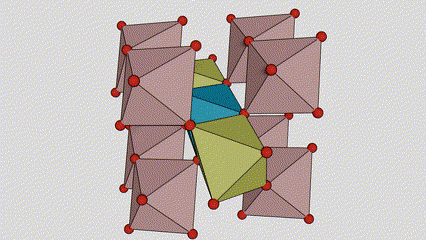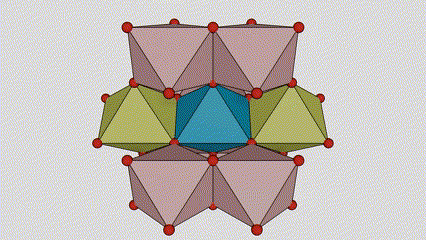
Rutilo faseko titanio dioxidozko kristal-zelularen diagrama eskematikoa (ezkerrean)
Titanio oxidozko oktaedroaren konexio metodoa (eskuinean)
(2) Anatasa faseko titanio dioxidoa
Anatasa faseko titanio dioxidoan, titanio-oxigeno oktaedro bakoitza inguruko 8 oktaedrori lotuta dago (4 ertz partekatu eta 4 erpin partekatu), eta 4 TiO2 molekulek unitate-zelula bat osatzen dute.
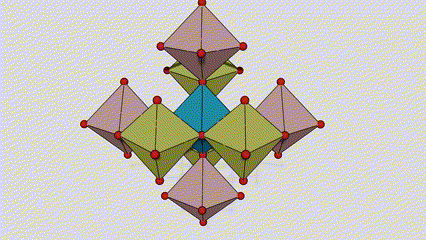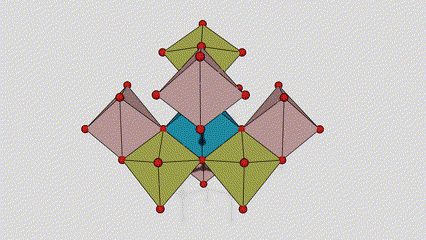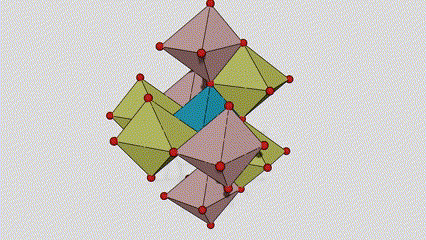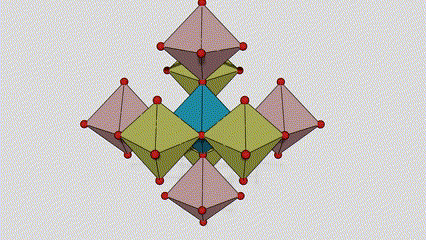
Rutilo faseko titanio dioxidozko kristal-zelularen diagrama eskematikoa (ezkerrean)
Titanio oxidozko oktaedroaren konexio metodoa (eskuinean)
Ⅲ.Titanio dioxidoaren prestaketa metodoak:
Titanio dioxidoaren ekoizpen-prozesuak batez ere azido sulfurikoaren prozesua eta klorazio-prozesua barne hartzen ditu.

(1) Azido sulfurikoaren prozesua
Titanio dioxidoa ekoizteko azido sulfurikoaren prozesuak titanio burdin hautsaren eta azido sulfuriko kontzentratuaren azidolisi erreakzioa dakar titanio sulfatoa sortzeko, eta ondoren hidrolizatzen da azido metatitaniko ekoizteko. Kaltsinatu eta xehatu ondoren, titanio dioxido produktuak lortzen dira. Metodo honek anatasa eta rutilo titanio dioxidoa ekoiz ditzake.
(2) Klorazio prozesua
Titanio dioxidoa ekoizteko klorazio-prozesuak rutilo edo titanio-eduki handiko zepa-hautsa kokearekin nahastea eta ondoren tenperatura altuko klorazioa egitea dakar titanio tetrakloruroa ekoizteko. Tenperatura altuko oxidazioaren ondoren, titanio dioxidoaren produktua iragazketa, urarekin garbitu, lehortu eta xehatu bidez lortzen da. Titanio dioxidoa ekoizteko klorazio-prozesuak rutilo produktuak baino ezin ditu ekoitzi.
Nola bereizi titanio dioxidoaren benetakotasuna?
I. Metodo fisikoak:
(1)Metodorik errazena ukimenaren bidez ehundura alderatzea da. Titanio dioxido faltsua leunagoa da, benetakoa, berriz, zakarragoa.

(2)Urarekin garbituz, titanio dioxido pixka bat eskuan jartzen baduzu, faltsua erraz kentzen da, benetakoa, berriz, ez da erraz kentzen.

(3)Hartu ur garbi kopa bat eta bota titanio dioxidoa bertan. Gainazalera flotatzen duena benetakoa da, eta hondora erortzen dena, berriz, faltsua (metodo honek ez du balio aktibatu edo eraldatutako produktuekin).
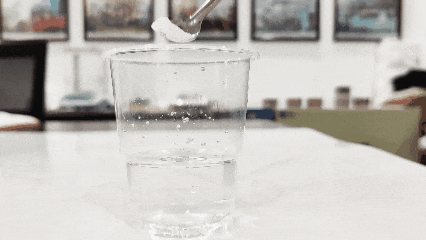

(4)Egiaztatu uretan duen disolbagarritasuna. Oro har, titanio dioxidoa uretan disolbagarria da (plastikoetarako, tintetarako eta titanio dioxido sintetiko batzuetarako bereziki diseinatutako titanio dioxidoa izan ezik, uretan disolbaezinak baitira).

II. Metodo kimikoak:
(1) Kaltzio hautsa gehitzen bada: Azido klorhidrikoa gehitzeak erreakzio bizia eragingo du kirrinka batekin, burbuila kopuru handia sortuz (kaltzio karbonatoak azidoarekin erreakzionatzen baitu karbono dioxidoa sortzeko).

(2) Litoponoa gehitzen bada: Azido sulfuriko edo azido klorhidriko diluitua gehitzeak arrautza ustelen usaina sortuko du.

(3) Lagina hidrofoboa bada, azido klorhidrikoa gehitzeak ez du erreakziorik eragingo. Hala ere, etanolarekin busti eta gero azido klorhidrikoa gehitu ondoren, burbuilak sortzen badira, laginak kaltzio karbonato hauts estaliak dituela frogatzen du.

III. Beste bi metodo on ere badaude:
(1) PP + % 30 GF + % 5 PP-G-MAH + % 0,5 titanio dioxido hauts formula bera erabiliz, zenbat eta erresistentzia txikiagoa izan emaitza den materialaren kasuan, orduan eta benetakoagoa da titanio dioxidoa (rutiloa).
(2) Aukeratu erretxina garden bat, hala nola ABS gardena % 0,5 titanio dioxido hautsarekin. Neurtu haren argi-transmitantzia. Zenbat eta txikiagoa izan argi-transmitantzia, orduan eta benetakoagoa da titanio dioxido hautsa.
Argitaratze data: 2024ko maiatzaren 31a





